Myoglobin hva er, egenskaper og drift av dette proteinet
- 1300
- 196
- Jonathan Solberg
Verden av menneskelig biokjemi forklarer i alle dens betydninger de metabolske prosessene som oppstår i oss. Utover eteriske konsepter og egne identiteter, må vi erkjenne at mennesket ikke er noe mer enn et sett med kjemiske ruter, elektriske impulser, cellulære pust og polypeptidkjeder, i det minste på et bare fysiologisk nivå.
Dermed, Tusenvis av små molekyler forklarer vår atferd, vaner og plager. Gastriske enzymer er ansvarlige for fordøyelse av magen, hemoglobin med røde blodlegemer tillater oksygenoverføring til vevet vårt, og frigjøring av synaptiske komplekser mellom nevroner er opplært til å tenke, verken mer eller mindre eller mindre. Enkelt: Vi er biomolekylene som vi syntetiserer, for små eller nimier som de ser ut til.
Blant alt det biologiske konglomeratet som er menneskekroppen, er det en serie proteiner eller konjugater som har ansvaret for veldig spesifikke funksjoner, som vanligvis slipper unna den generelle omsorgen for det spesifikke språket som innebærer. Her får vi se hva som er Myoglobin, et muskel heteroprotein som har mange likheter med klassisk hemoglobin.
- Beslektet artikkel: "Sirkulasjonssystem: Hva er, deler og egenskaper"
Hva er myoglobin?
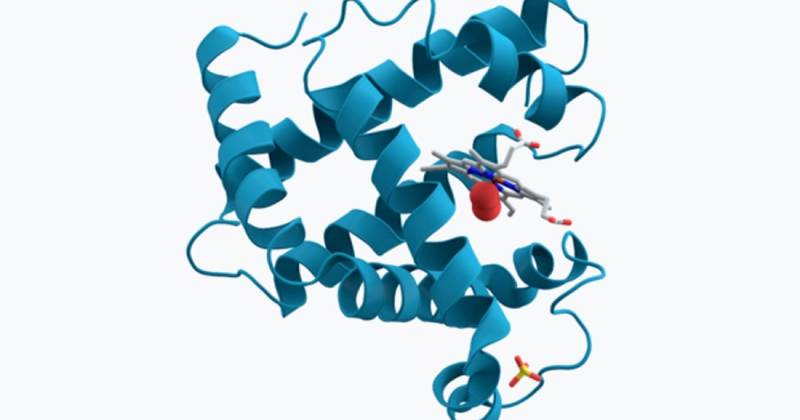
Myoglobin er et heteroprotein, det vil si at det er sammensatt av en proteindel (apoprotein, aminosyrer forenet med peptidbindinger) og et annet ikke -protein av mindre størrelse, Protesegruppen. Den viktigste differensielle karakteristikken mellom et protein som skal brukes (holoprotein) og et heteroprotein er at sistnevnte presenterer lipid, karbohydrater, nukleinsyrer og til og med metaller i sin tre -dimensjonale struktur.
Tuning mer tråd, kan vi understreke at myoglobin er Et kromoprotisk heteroprotein, siden det presenterer et metall i sin kjemiske sammensetning, som gir den en karakteristisk farging. Myoglobin er sammensatt av et polypeptidseksjon av 153 aminosyrer og en hemo -gruppe som inneholder et jernatom, akkurat som hemoglobin. På grunn av denne "hemo" -gruppen, kan vi bekrefte at hovedfunksjonen til myoglobin lagrer oksygen.
I tillegg skal det bemerkes at myoglobin Den er sammensatt av en enkelt polypeptidkjede dannet av 8 alfa -propeller (sekundær struktur av aminosyrekonformasjon), som er assosiert med et oksygeninnsatsspunkt. I sentrum presenterer den en porfyrinring som inneholder jern. En proksimal histidinkruppe (His-93) er direkte assosiert med jernmolekylet, mens en distal histidinkruppe (His-64) er plassert på motsatt side av formasjonen.
I kontrast er hemoglobin (ansvarlig for transport av oksygen i blod, innenfor røde blodlegemer) sammensatt av fire forskjellige polypeptider og fire oksygenbindingspunkter, noe som tillater forskjellige kinetiske bindingsegenskaper. Du kan si det, Fra et kjemisk synspunkt er dette mer "komplekst" enn myoglobin.
Hvis vi vil at du skal være med en ide om alt dette konglomeratet, er det som følger: Myoglobin dannes bare av en aminosyrekjede (polypeptid), som igjen forekommer i form av 8 alfakoblede haller, anordnet i en Rullet vei tre -dimensjonal konformasjon. I sentrum av heteroprotein er det en hemokruppe, med et jernmolekyl. Hvis vi kunne slappe av dens tertiære struktur, ville vi se en streng med 8 underenheter festet til en hemo -ring.
- Du kan være interessert: "Erythrocytter (røde blodlegemer): Kjennetegn og drift"
Myoglobin -funksjon
Som hemoglobin, myoglobin Det er et cytoplasmatisk heteroprotein som muliggjør oksygenforeningen til en hemokruppe. Uansett, med fire polypeptidkjeder (globin), har hemoglobin fire hemo -grupper, som lar den feste seg mer oksygen til dens tertiære struktur. Dermed har hemoglobin mer "oksygenbelastning", mens myoglobin har en større affinitet til det, men i mindre mengde (bare en hemo/et O2 -molekyl). Disse forskjellene er i forbindelse med funksjonaliteten til hvert molekyl: Hemoglobin Transports, mens Myoglobin -butikker.
På dette tidspunktet skal det bemerkes at Myoglobinkonsentrasjoner er maksimalt i den stripete muskulaturen av virveldyr, Spesielt i cytoplasmaet til kardiomyocytter og i sarkoplasmaet til muskelfibre. Basert på dette forutsetningen kan det antas at hovedfunksjonen til myoglobin er å bidra med oksygen til muskelmitokondrier når organismen er i en innsats for å unngå hypoksi på vevsnivå.
Med andre ord, myoglobin fungerer som en buffer av den intracellulære oksygenkonsentrasjonen og også som en O2 -reserve på muskelnivå. Dette konseptet bekreftes av en realitet så nysgjerrig som forventet: dyr som lever i vannet og tilbringer store perioder med nedsenket tid har 30 ganger mer myoglobin i cellemiljøet sitt, sammenlignet med de som har oksygen tilgjengelig til enhver tid.

Disse er Noen flere funksjoner av myoglobin, kontekstualisert i organismemiljøet:
- Det letter diffusjonen av oksygen: dette heteroproteinet trekkes i begynnelsen av muskelaktiviteten, noe som øker oksygendiffusjonsgradienten fra kapillærer til cytoplasma.
- Det ser ut til å ha enzymatiske funksjoner: det er nødvendig for aktivt nitrogenoksid for å nitrat. Nitrogenoksidmetabolisme favoriserer mitokondriell aktivitet.
- Det hjelper til. Derfor hjelper myoglobin dens konsentrasjoner å være minimale.
Som du kan se, Funksjonaliteten til myoglobin ligger ikke bare i lagring av et O2 -molekyl takket være hemo -gruppen. Selv om dette er hovedarbeidet ditt, presenterer det også andre, like viktig for å være i cellemiljøet.
Myoglobinens rolle i kliniske malerier
Myoglobin er kodet av MB -genet hos mennesker, og som enhver ryddig sekvens av DNA, er dette mottakelig for mutasjoner. Dysfunksjonaliteten til MB -genet har vært assosiert med forskjellige forhold, for eksempel romsyndrom eller medulloblastom.
I tillegg utvikler eksperimentelle modeller (knockout -mus) med mutert myoglobin dødelige sykdommer på hjertet under fosterutvikling. De få modellene som overlever disse forholdene uttrykker kompensasjonsmekanismer, men overlevelsen er lav. Derfor uttales det at myoglobin Det er viktig for kroppsfunksjon.
Utover Conjectural Terrain har det vært direkte assosiert med myoglobin med en kjent klinisk enhet: Rabdomiolyse. I denne alvorlige tilstanden produseres skade på myocyttmembranen (muskelcelle), som stammer i akkumulering av unormal kalsium inne i muskelen i myocyttmembranen (. Dette antar lyser og muskuløs nekrose, som igjen øker blodkonsentrasjonen av molekyler som ikke skal være der.
Interessant nok, myoglobin Det er proteinet som genererer mer skade i nyrene når det infiltrerer sirkulasjonssystemet og ender opp med å bli "filtrert" i nyremiljøet. Det antas at dette heteroproteinet kan utfelle i nyretubuli, akkumulere og forårsake hindringer. Denne toksisitetsmekanismen forklarer delvis hvorfor nyresvikt er en av de viktigste bivirkningene av rabdomyolyse.
Til slutt skal det bemerkes at tilstedeværelsen av myoglobin i urinen måles for å oppdage denne tilstanden, siden en konsentrasjon på 100 mg/dL er i stand til å endre fargen på pis.
Sammendrag
Når vi tar hensyn til et protein, enzym eller molekyl relatert til metabolisme, er det en alvorlig feil å holde seg alene med hovedstrukturen og funksjonen. Ja, myoglobin lagrer oksygen for å unngå muskelhypoksi, men har også enzymatisk aktivitet, nøytraliserer reaktive oksygenarter, letter diffusjonen av O2 i cellemiljøet og fungerer som et av diagnostiske kriterier for rabdomyolyse (enten i konsentrasjonsplasmaet eller urinen).
Tross alt har hver biomolekyl mer enn en funksjon i kroppen vår, og hvis vi tror at det bare oppfyller en jobb, vil det helt sikkert være fordi vi ikke har oppdaget resten.

